BEBERAPA OKSIDATOR DALAM LABORATORIUM (ION PERMANGANANAT, ION KROMAT DAN ION KROMAT)
Dalam
laboratorium terdapat beberapa zat yang dapat digunakan sebagai
oksidator. Oksidator yaitu zat yang dapat menyebabkan zat lain mengalami
oksidasi sehingga dirinya sendiri akan mengalami reduksi. Umumnya
unsur-unsur nonlogam merupakan oksidator yang baik karena memiliki
keelektronegatifan tinggi sehingga mudah menangkap atau menarik elektron
kearah dirinya. Walaupun demikian tidak selalu digunakan unsur dalam
semua reaksi kimia.
Dalam
laboratorium terutama reaksi redoks yang dilangsungkan dalam bentuk
larutan yang biasa digunakan sebagai oksidator adalah ion permangananat
(MnO4-), ion kromat (CrO42-), ion kromat (Cr2O72-).
Ketiga zat tersebut merupakan oksidator yang kuat dan mudah melepas
oksigen sehingga penanganannya perlu berhati-hati. Zat-zat ini harus
disimpan ditempat tersendiri dan tidak boleh berada di dekat zat-zat
organik karena dapat menyebabkan kebakaran.
Bila mengenai
anggota segera bilas dengan air yang mengalir. Bila mengenai mata segera
rendam mata dalam air, hal ini dapat dilakukan dengan cara membuka mata
dalam aquades yang disimpan dalam baskom atau ember besar. Setelah itu
segera di bawa ke dokter atau memberi obat tetes mata. Bila sampai
tertelan segera minum air sebanyak-banyaknya untuk mengencerkan zat
kimia yang tertelan lalu segera di bawa ke dokter. Oleh sebab itu, dalam
melakukan praktikum jangan pernah mengambil semua larutan dengan cara
menyedot.
ION PERMANGANANAT (MnO4-)
Ion permanganat
berwarna ungu demikian pula larutan yang mengandung ion permanganat.
Warna tersebut merupakan ciri khas dari ion permanganat. Biasanya dalam
laboratorium ion permanganat diperoleh dari garam kalium permanganat
(KMnO4). KMnO4 merupakan suatu kristal berwarna hitam keunguan.
Gambar Kristal kalium permanganat dan larutan kalium permanganat
Bila terkena cahaya atau dipanaskan pada suhu 230°C, kalium permanganat akan terurai sesuai reaksi berikut.
2 KMnO4 → K2MnO4 + MnO2 + O2
Bilangan oksidasi mangan dalam KMnO4 adalah +7. Ketika terjadi reaksi kimia bilangan oksidasi mangan turun atau mengalami reduksi. Reaksi reduksi mangan dalam KMnO4 bergantung pada keasaman larutan. Dalam suasana larutan asam kuat mangan direduksi menjadi Mn2+ dan warna larutan memudar (hampir tidak berwarna). Setengah reaksi reduksi ion permanganat dalam suasana asam.
8H+ + MnO4- + 5e → Mn2+ + 4H2O
Dalam suasana netral atau sedikit basa ion MnO4- direduksi menjadi MnO2
yang tidak larut dalam larutan atau membentuk endapan. Oleh sebab itu
dalam melakukan titrasi pada suasana basa atau suasana alkalis, larutan
yang mengandung ion MnO4- tidak disarankan karena endapan MnO2
yang terbentuk dapat mengaburkan titik akhir titrasi. Setengah reaksi
reduksi ion permanganat dalam suasana netral atau alkalis.
2H2O + MnO4- + 3e → MnO2 + 4OH-
Untuk membuat
suasana asamsebaiknya dipakai asam sulfat, karena asam ini tidak
menghasilkan reaksi samping. Sebaliknya jika dipakai asam klorida dapat
terjadi kemungkinan teroksidasinya ion klorida menjadi gas klor dan
reaksi ini mengakibatkan dipakainya larutan permanganat dalam jumlah
berlebih. Meskipun untuk beberapa reaksi dengan arsen(III) oksida,
antimon(II) dan hidrogen peroksida, karena pemakaian asam sulfat justru
akan menghasilkan beberapa tambahan kesulitan.
Kalium pemanganat adalah oksidator kuat, oleh karena itu jika berada dalam HCl akan mengoksidasi ion Cl-
yang menyebabkan terbentuknya gas klor dan kestabilan ion ini juga
terbatas. Biasanya digunakan pada medium asam 0,1 N. Namun, beberapa zat
memerlukan pemanasan atau katalis untuk mempercepat reaksi. Seandainya
banyak reaksi itu tidak lambat, akan dijumpai lebih banyak kesulitan
dalam menggunakan reagen ini.
Reaksi reduksi
ion permanganat juga dapat berlangsung dalam suasana netral dan basa
kuat, Perekasi kalium permanganat tidak merupakan pereaksi baku primer.
Sangat sukar untuk mendapatkan pereaksi dalam keadaan murni, bebas dari
mangan(IV) oksida (mangan dioksida). Lagi pula air dipakai sebagai
pelarut sangat mungkin masih mengandung zat pengotor lain yang dapat
mereduksi permanganat menjadi mangan dioksida.
Timbulnya
mangan dioksida justru akan mempercepat reaksi reduksi permanganat.
Demikian juga adanya ion mangan(II) dalam larutan akan mempercepat
reduksi permanganat menjadi mangan dioksida, reaksi tersebut berlangsung
sangat cepat dalam suasana netral. Dengan adanya alasan-alasan tersebut
maka pembuatan larutan baku permanganat dilakukan sebagai berikut.
Larutkan sejumlah(gram) pereaksi dalam air kemudian didihkan selama satu
jam diatas penangas air. Selanjutnya disaring lewat penyaring yang
bebas dari zat pereduksi.
Wadah
bertutupkan sumbat kaca yang dipakai untuk menyimpan larutan, harus
benar-benar bebas dari zat pengotor seperti lemak atau zat pengotor
lain. Untuk keperluan ini biasanya wadah tersebut dicuci bersih memakai
campuran larutan kalium dikromat dan asam sulfat pekat, diikuti
pembilasan dengan aquades. Larutan ini sebaiknya disimpan ditempat
gelap, terhindar dari cahaya, karena itu sebaiknya dipakai botol
berdinding gelap.
Reaksi asam sulfat pekat dengan KMnO3 membentuk Mn2O7.
Reaksi ini berlangsung sangat eksotermsis dan dapat meledak. Demikian
juga dengan asam klorida membentuk gas glor yang sangat beracun. Reaksi
antara asam nitrat dengan alkena akan memutuskan ikatan rangkap dua dan
diperoleh suatu asam karboksilat.
CH3(CH2)17CH=CH2 + 2KMnO4 + 3H2SO4 → CH3(CH2)17COOH + CO2 + 4H2O + K2SO4 + 2MnSO4
KMnO4 juga dapat mengoksidasi aldehida menjadi asam karboksilat. Misalnya mengoksidasi n-heptanal menjadi asam heptanoat.
5C6H13CHO + 2KMnO4 + 3 H2SO4 → 5C6H13COOH + 3H2O + K2SO4 + 2MnSO4
Selain itu KMnO4 juga dapat mengoksidasi gugus metil yang terikat pada cincin benzena. Misalnya mengoksidasi toluena menjadi asam benzoat.
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 14H2O + 2K2SO4 + 6MnSO4
ION KROMAT (CrO42-) DAN DIKROMAT (Cr2O42-)
Dalam
laboratorium pasti dijumpai garam yang mengandung ion kromat dan
dikromat. Garam yang sering dijumpai yaitu kaliium dan natrium kromat
atau dikromat dengan rumus kimia Na2CrO7 (natrium kromat), K2CrO7 (kalium kromat) dan Na2Cr2O7 (natrium dikromat), K2Cr2O7 (kalium dikromat).
Gambar Empat larutan kromium. Dari kiri: larutan yang berwarna kuning adalah kalium dikromat (K2Cr2O7, orange) dan natrium kromat (Na2CrO4), hijau adalah kromium(III) klorida (CrCl3), ungu adalah kromium(III) nitrat (Cr(NO3)3).
Gambar Kristal beberapa senyawa kromium. Dari kiri ke kanan : Natrium kromat tetrahidrat (Na2CrO4·4H2O), kalium dikromat (K2Cr2O7), amonium dikromat ((NH4)2Cr2O3), kromium trioksida (CrO3), kromium oksida (Cr2O3)
Baik ion kromat
maupun dikromat mengandung kromium dengan bilangan oksidasi +6 yang
merupakaan keadaan oksidasi tertinggi dari krom dalam senyawaaannya.
oleh sebab itu dalam reaksi kimia ion kromat dan dikromat akan mengalami
reaksi reduksi. Reaksi reduksi ion kromat dan dikromat bergantung pada
keasaman larutan.
Warna kuning
merupakan ciri khas adanya ion kromat dalam larutan sedangkan warna
merah merupakan ciri khas adanya ion dikromat. Larutan yang mengandung
ion kromat yang berwarna kuning bila diasamakan, akan diperoleh larutan
yang berwarna merah jingga karena ion CrO42- berubah menjadi Cr2O72-.
2CrO42- + 2H+ → Cr2O72- + H2O
Sebaliknya jika larutan yang mengandung ion dikromat dibasakan maka ion Cr2O72- berubah menjadi ion CrO42-.
Cr2O72- + 2OH- → 2CrO42- + H2O
Oleh sebab itu, jika reaksi berlangsung dalam suasana asam yang bertindak sebagai oksidator adalah Cr2O72- dan sebaliknya bila reaksi dilangsungkan dalam suasana basa yang bertindak sebagai oksidator adalah CrO42-.
Dalam reaksi
kimia bila ion kromat dan dikromat bertindak sebagai oksidator (ketika
direaksikan dengan suatu reduktor) bilangan oksidasi kromium turun
menjadi +3 dan produk yang diperoleh bergantung pada keadaan keasaman
larutan.
Dalam larutan asam ion kromium direduksi menjadi ion Cr3+, dalam larutan sedikit basa produk reduksinya adalah Cr(OH)3 yang tidak larut dan dalam larutan sangat basa ion kromat direduksi menjadi ion kromit (CrO2-). Persamaan reaksi yang terjadi sebagai berikut.
Larutan asam
6e + 14H+ + Cr2O7 → 2Cr3+ + 7H2O
Larutan sedikit basa
3e + 4H2O + CrO42- → Cr(OH)3 + 5OH-
Larutan sangat basa
3e + 2H2O + CrO42- → CrO2- + 4OH-
Baik Na2CrO7 (natrium kromat), K2CrO7 (kalium kromat), Na2Cr2O7 (natrium dikromat) mapun K2CrO7 (kalium dikromat) bersifat higoskopis sehingga dapat membentuk tetra-, heksa-, dan dekahidrat.
Natrium kromat (Na2CrO4)
digunakan sebagai inhibitor korosi dalam industri minyak bumi, sebagai
reagen pencelupan dalam industri tekstil, sebagai pengawet kayu. Dengan
memanfaatkan isotop Cr-51 dengan waktu paruh 27,8 hari, larutan natrium
kromat (VI) digunakan dalam obat-obatan untuk penentuan volume sirkulasi
sel darah merah, waktu kelangsungan hidup sel dan evaluasi kehilangan
darah.
Campuran kalium
dikromat dengan asam nitrat 35% diperoleh suatu larutan yang disebut
larutan Schwerter’s yang digunakan untuk menguji keberadaan berbagai
logam terutama perak. Perak murni mengubah larutan menjadi merah terang,
perak sterling (paduan 92,5% perak dengan logam lain biasanya tembaga
atau emas) mengubah larutan menjadi merah gelap, larutan menjadi
berwarna coklat bila kandungan tembaga tinggi bahkan menjadi hijau.
SUMBER
James E. Brady. Kimia universitas asas dan struktur edisi keliama jilid 1.
Vogel Analisis Anorganik Kualitatif Makro Dan Semimikro (terjemahan Setiono & Pudjaatmaka) Edisi kelima.
Underwood, A. L
& R. A Day, Jr. 1999. Analisis Kimia Kuantitatif (terjemahan A.
Hadyana Pudjaatmaka) Edisi kelima. Jakarta: Penerbit Erlangga.
Devy
Agustyaningsih. 2010. Penetapan Kadar Kalium Permanganat Menggunakan
Fotometer Sederhana Berbasis LED dan CdS Fotosel Detektor. Skripsi
Universitas Negeri Malang Fakultas Matematika dan Ilmu Pengetahuan Alam
Program Studi Kimia.
Sumber internet
Wikipedia.org
uncp.edu/home/mcclurem/ptable/chromium/cr.htm
NITROGEN, ASAM NITRAT DAN PREPARASI NITROGEN DALAM LABORATORIUM
Posted by pada 7 Januari 2012
NITROGEN
Nitrogen adalah
unsur nonlogam dalam tabel periodik terletak pada golongan VA atau
golongan 15 dan memiliki lambang N dengan nomor atom 7. Pada suhu kamar
berupa gas tidak berwarna, tidak berbau, tanpa rasa dan berupa unsur
diatomik (N2). Nitrogen yang telah dicairkan juga tidak berwarna dan tidak berbau.
Gambar Rumus Molekul nitrogen dan nitrogen cait
Nitrogen sangat
sulit bereaksi dengan unsur atau senyawa lainnya sehingga disebut juga
dengan nama zat lemas. Nitrogen merupakan gas yang paling banyak di
atmosfer sekitar 78%. Selain di atmosfer, nitrogen juga terdapat di
planet mars (3%).
Ikatan kimia
antara dua atom dalam molekul nitrogen adalah ikatan terkuat antara dua
atom dari unsur yang sama. Hal ini membuat gas N2 sangat
stabil dan inert. Dalam jaringan tubuh makluk hidup, sebagian mengandung
nitrogen, misalnya dalam protein dan asam nukleat menjadi salah satu
komponen pembentuk DNA dan RNA.
Terdapat 2 isotop nitrogen yang stabil yaitu: 14N dan 15N. Isotop yang paling banyak adalah 14N (99.634%), yang dihasilkan dalam bintang-bintang dan yang selebihnya adalah 15N.
Dalam industri
nitrogen diperoleh dari pencairan udara dengan memberi tekanan yang
cukup tinggi, kemudian dilanjutkan dengan destilasi fraksional atau
destilasi fraksinasi.
Ketika nitrogen dipanaskan, dapat bereaksi secara langsung dengan magnesium, lithium dan kalsium.
6 Li + N2 → 2 Li3N
3Mg + N2 → Mg3N2
Ketika dicampur dengan oksigen dan dikenakan bunga api listrik, membentuk oksida nitrat (NO) kemudian menjadi dioksida (NO2). Bila dipanaskan di bawah tekanan dengan hidrogen dan adanya katalis yang cocok akan terbentuk amonia (proses Haber).
Senyawa
nitrogen yang banyak dimanfaatkan dalam dunia industri maupun dalam
laboratorium yaitu asam nitrat dan amonia (paling banyak dalam
industri). Amonia, NH3 merupakan hidrida nitrogen yang
beracun dan merupakan bahan dasar paling penting untuk kimia nitrogen
dan merupakan salah satu bahan kimia yang paling banyak diproduksi di
dunia. Amonia digunakan sebagai bahan dasar pupuk nitrogen seperti urea
dan bahan peledak.
PREPARASI NITROGEN DALAM LABORATORIUM
Di
laboratorium, nitrogen dipersiapkan dengan memanaskan campuran amonium
klorida dan natrium nitrit dan sedikit air. Jika amonium nitrit
dipanaskan akan terurai menghasilkan gas nitrogen. Namun, reaksi ini
sangat cepat dan mungkin eksplosif.
Untuk keamanan,
campukan amonium klorida dan natrium nitrit dengan perbandingan massa
4:5, kemudian dipanaskan dengan sedikit air. Keberadaan air mencegah
amonium klorida mensublimasi ketika dipanaskan. Awalnya, dua zat
mengalami penguraian ganda untuk membentuk natrium klorida dan amonium
nitrit.
Amonium nitrit yang terbentuk kemudian terurai menjadi gas nitrogen dan air.
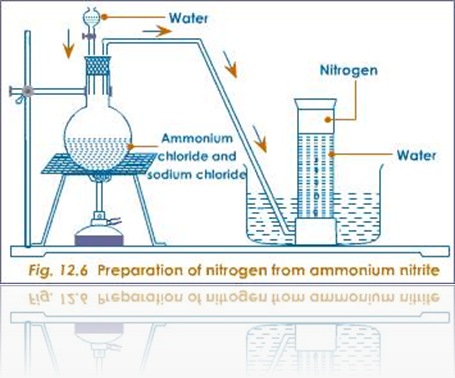
Gas nitrogen
yang terbentuk kemudia dialirkan melalui air seperti pada gambar. Dengan
cara ini maka uap air akan tertinggal sedangkan gas nitrogen terus ke
atas karena kelarutannya yang rendah dalam air.
ASAM NITRAT
Asam nitrat adalah asam kuat yang bersifat korosif dan beracun dan terurai menjadi ion H+ dan ion NO3- dalam air, persamaan reaksinya.
Asam nitrat biasa memiliki konsentrasi 68%. Larutan HNO3
dengan konsentrasi diatas 86% disebut sebagai asam nitrat berasap. Asam
nitrat murni merupakan suatu cairan tidak berwarna yang dapat berubah
menjadi merah kekuningan karena adanya oksida nitrogen terlarut dan
berwarna merah pada suhu tinggi. HNO3 menjadi padatan putih berwarna pada suhu dibawah -41°C dan mendidih pada 83°C.
Asam nitrat
merupakan oksidator yang kuat sehingga penanganannya harus berhati-hati.
Bila mengenai anggota tubuh segera dicuci dengan air yang mengalir.
Gambar Asam nitrat murni yang berwarna kekuningan karena adanya oksida nitrogen terlarut dan asam nitrat 70% yang tidak berwarna
Air Raja
Campuran antara asam klorida pekat dan asam nitrat pekat dengan perbandingan 3:1 (misalnya 3 mL HCl dengan 1 mL HNO3 atau 3L HCl dengan 1 L HNO3) disebut aqua regia atau air raja
karena dapat melarutkan logam mulia seperti emas dan platina. Aqua
regia sangat tidak stabil, oleh sebab itu aqua regia baru dibuat ketika
akan digunakan.
Sifa-sifat asam nitrat
Asam nitrat
merupakan oksidator yang kuat yang mudah melepaskan oksigen sehingga
penyimpanannya harus ditempat tersendiri dan hindari bahan-bahan organik
yang umumnya mudah terbakar. Dalam reaksi kimia bila konsentrasi
tinggi, HNO3 tereduksi menjadi NO2 sedangkan pada konsentrasi rendah tereduksi menjadi NO.
Pemanasan HNO3 akan terurai menghasilkan NO2.
Reaksi asam nitrat dengan nonlogam dan logam
Menjadi agen
oksidasi yang kuat, asam nitrat bereaksi hebat dengan banyak non-logam,
logam, senyawa dan reaksi mungkin berlangsung eksplosif. Kecuali emas
dan platina, HNO3 hampir bereaksi dengan semua unsur logam.
Produk yang
terbentuk tergantung pada sifat logam (kereaktifan logam), konsentrasi
asam dan suhu. Reaksinya dengan logam yang kurang reaktif hasil
reduksinya berupa gas NO sedangkan bila digunakan HNO3 pekat hasil reduksinya gas NO2. Beberapa contoh reaksi asam nitrat sebagai berikut.
Reaksi karbon dengan asam nitrat
C + 4HNO3 → CO2 + 4NO2 + 2H2O
3C + 4HNO3 → 3 CO2 + 4NO + 2H2O
Reaksi belerang dan iod dengan asam nitrat
S(s) + 2HNO3(aq) → H2SO4(aq) + 2NO(g) (HNO3 pekat dingin)
3I2(s) + 10HNO3(aq) → HIO3(aq) + 2H2O(l) + 10NO(g) (HNO3 pekat panas)
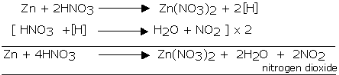
Reaksi seng dengan asam nitrat
Reaksi magnesium dengan asam nitrat
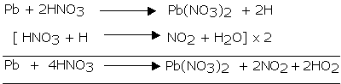
Reaksi timbal dengan asam nitrat
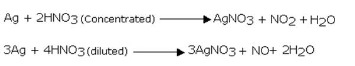
Reaksi perak dengan asam nitrat
Trinitro Toluena (TNT)
Campuran asam
nitrat pekat dan asam sulfat pekat bila direaksikan dengan toluena akan
diperoleh suatu senyawa yang disebut trinitro Toluena (TNT). Trinitro
toluena merupakan suatu senyawa yang sangat ekplosif.
Sumber :
http//Asmal Ardianto,blogspot.com















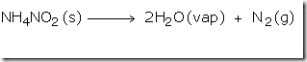


0 Response to "ION PERMANGANANAT, ION KROMAT DAN ION KROMAT"
Post a Comment